共進化による生物の多様化とは?
恐竜時代の大きな出来事のひとつに被子植物の誕生とその躍進があります。
恐竜時代の後半、白亜紀に被子植物が登場し、それ以後のめざましい進化によって次第に陸上の植物相が大きく変わってゆきました。白亜紀の時代は恐竜の進化と被子植物の進化が互いに深く影響しながら進んだ期間だったのではないかという考えが登場しました。しかし、被子植物の登場・発展と恐竜進化の大きな変化といわれているいくつかの出来事の間には時期的なずれなどがあり、この考えを支持する証拠は得られていません。一方、被子植物の歴史に明らかに深くかかわってきた昆虫については新しい発見が続いています。
恐竜時代に現れた被子植物
同じ種子植物でも、はるかに先立って繁栄していた裸子植物(gymnosperm)と異なり、被子植物(angiosperm)は卵細胞を含む胚珠(はいしゅ)が子房(しぼう)という構造の中に包み込まれています(裸子植物の胚珠はむき出しになっています)。それだけでなく、裸子植物では受精に長い時間がかかるのですが、一般に被子植物には素早く受精して繁殖できるという大きな特徴があります。
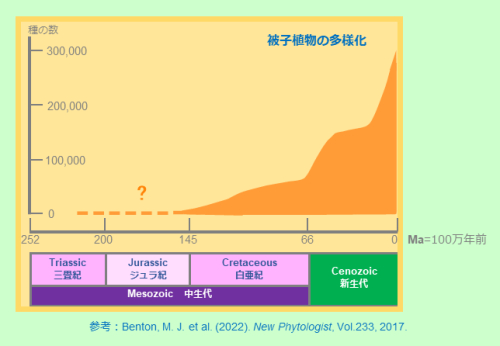
最も古い被子植物由来と確かに判定できる花粉の化石は1億3000万年ほど前の白亜紀初期のものが知られています(文献1~4)。現生植物から系統をさかのぼる推定では、それよりも古いジュラ紀、またはそれ以前に起源があるのではないかとされています。白亜紀の終わりに向け、被子植物は次第に種類(多様性)を増やしていきます。新生代に入ってさらに勢いを得た被子植物は現在では30万種以上の最も繁栄している植物グループとなりました。
白亜紀になって植物食恐竜の主要メンバーが変わったことが植物の繁栄に影響? さらに両者が影響し合ってシンクロした進化も?
中生代ジュラ紀の終わりにむけて巨大化した竜脚類(sauropod、話題17、27、42)は、それまで生態系の中の主な植物食動物でした。白亜紀に入ると、中心となる植物食恐竜は鳥盤類(ornithischia)へと、そのメンバーが変わります。その内訳はハドロサウルスなどの二足歩行の鳥脚類(ornithopod)の恐竜、そしてアンキロサウルス類、やがてはトリケラトプスのような、より低姿勢で食事をとる四足歩行の恐竜たちです。大型竜脚類はその巨体と長い首で背の高い樹木の上部の部分を食べることができた一方、そこまで大きくなく、首も長くない低姿勢をとる鳥盤類恐竜はより背の低い植物を口にします。
高層、低層、それぞれの植生の植物が植物食恐竜から受けていた影響が、白亜紀に入って変化したのではないかというこの点に注目したのが1978年の論文(文献5)です。竜脚類による高層植物の消費から低層植物の消費中心への切り替わりは、低層植物の中で素早く繁殖する被子植物に有利な環境をもたらしうるからです。恐竜側の変化と被子植物の繁栄の時期が一致していたということから、被子植物の繁栄に恐竜が深くかかわっていたのではないかというのです。
中生代の中~後期の間は大型植物食恐竜が植物食動物の中心的なメンバーでした。彼らは多くのエネルギーを得るために、植物の種類にはあまりかまうことなく多量に食べていたとみられています。植物側にとって、この状況は小ぶりで成長が早く、繁殖までの期間が短い被子植物に好都合となるという考えはその後の研究でも取りあげられています(文献6)。それだけでなく、これがまた大型植物食恐竜の食糧の幅を広げることにもなり、この相互作用による進化が続いたかもしれないと考えられました。
植物食恐竜側にはさらなる重要な変化がありました。新しい咀嚼(そしゃく)方法の獲得です(文献7)。植物食恐竜のなかでも鳥脚類はあごを横方向にも動かすことで口に含んだものをしっかりと噛むことができるようになり、より多くの種類の植物を食べることが容易になりました。関連して緻密な歯列の構造は動物の進化上、大変特異的なものに進化しています(話題36)。効率よく食べることができるようになった鳥脚類の進出によって、裸子植物よりもすばやく繁殖する被子植物が勢力を増してくる植物相のシフトが促進された可能性、そしてこれによって鳥脚類恐竜側の多様性もさらに進むという両者で進化を促し合った可能性が示されました。
しかし、その後の研究結果は?
ジュラ紀に比べると、白亜紀ではより地面に近い植物の消費が進んだことは北米では確からしいものの、植物相全体の変化に直接かかわったかどうかについては、詳しく考察するためのデータはそろっていないといわざるをえない状況(文献8)がありました。その後に蓄積されてきたデータをもとにした進化系統経路の推定の進展の結果からは、鳥盤類の咀嚼メカニズムの変化と被子植物の進化との時間的関連はないだろうという見解も出ました(文献9)。
そして、2001年にはそれまでの諸説を紹介しつつ、恐竜の進化が被子植物の進化を促したことを支持する証拠はないと結論づける論文が発表されます(文献10)。恐竜と被子植物の進化におけるメインの出来事が、時間と場所を考慮すると関連しているとはいえないということになったからです。さらに、ジュラ紀でも背の低い植物を食べる恐竜は一定程度存在していて、口にする植物が高層のものか、低層のものかという植生の違いに対するジュラ紀から白亜紀にかけての動物側の変化は劇的なものではなかったと考えました。ジュラ紀に栄えたステゴサウルス類は後ろ足で立ち上がったり、前足の片方を持ち上げて3本足で体を支えて伸びあがり、高い場所にも口が届いたという考えがありましたが、がっしりと重いこの恐竜が果たしてそうした姿勢をとれたかは疑問視され、ジュラ紀のうちのもっぱら低層植物に特化した重要な植物食動物とみなします。首の長い竜脚類のほうも背の高い植物ばかりを食べていたと一概に決めることはできません。また、成長中の個体は当然ながら、成体と同じような高さの樹木に届くことは無理です。
ただし、この論文も恐竜と被子植物の進化に関連があった可能性を完全に否定しているわけではありません。
一般に恐竜と被子植物に限らず、植物食の動物とこれに食べられる植物との関係は複雑です。この論文で論及しているように、植物にとって動物は単に食べに来るだけの存在ではなく、未消化の種子を地上に拡散してくれる役割も考えられ、昆虫のような小さな動物は花粉の媒介にかかわってきます。大きな動物からは重い体で繰り返し踏まれていくことの影響も受けます。一方、動物側にとっても植物の示す防御(棘(とげ)などの物理的なものや、忌避(きひ)物質、毒物のような化学的なものも)への対応が必要になることもありえます。さらに、植物は積極的に動物を誘うために色や香りを発達させることもあります。こうした一般的にありうる相互作用が恐竜と植物の進化それぞれにも及ぼしたなんらかの影響はありそうに思えますが、前提条件といえるメインの出来事の時間的、場所的な一致がみられないことはなんとしても大きなことです。昆虫や樹上生活をする哺乳類のほうが恐竜より大きな役割を果たした可能性が高かっただろうとこの論文(文献10)は言及しています。それ以外にも被子植物の進化には植物間の関係がかかわってくることは当然です。また、この論文は被子植物の進化初期に影響した生物以外の可能性のある要因として、大気中の二酸化濃度の増加を挙げています。
2009年になると、より詳しく恐竜と植物の進化を比較した報告が出ました(文献11)。
恐竜は407、植物は2,300をこえる当時最新の分類グループ(植物については恐竜の化石が得られている地域のもののみ)のデータを使い、これら分類グループについての時代にともなう多様性の変化を調べました。被子植物の最古の確かな化石の証拠は白亜紀前期中のバレミアン(Barremian、1億2,940万年前~1億2,500万年前)の時代の地層から得られています。しかし、目立った多様性の増加は白亜紀前期の終わりから後期の始めにわたるアルビアン(Albian、1,130万年前~1,005万年前)~セノマニアン(Cenomanian、1,005万年前~939万年前)の間。統計解析の結果は、ひとつの例外を除いて主な植物食恐竜と被子植物の多様性の変化は時代区分の中で一致しないというものでした。その例外というのは、白亜紀の中でのステゴサウルス類の多様性の低下と被子植物の多様性の増加です(ステゴサウルス類の多くが絶滅したジュラ紀/白亜紀境界の後の出来事です)。それ以外の点では、先の論文と同様に、恐竜の進化の中でにみられた大きな様相の変化が被子植物のそれと時代がずれているという結論で、全般的に植物食恐竜と被子植物が深く相互作用しながら進化したという考えには合わないことがこの研究でも示されました。
白亜紀前半の間のステゴサウルス類の衰退(この論文(文献11)でもステゴサウルス類はその前の時代であるジュラ紀中~後期の低層植物を多く消費する植物食の役割を果たしていたとみています)と被子植物の進展の間にはなんらかの関係があった可能性は残りました。しかし、そのころはまだ被子植物の存在はまれで、恐竜の生活に大きな影響をおよぼしたとは考えにくいという状況があります。裸子植物との関連の可能性については、ステゴサウルス類には飲み込んだソテツ類などの種を未消化のまま排泄して地上に拡散する役割も想像されています(文献12)。ソテツ類の衰退は、しかしながら、ステゴサウルス類の衰退よりも遅れているとされています。別の研究でも、ソテツ類と植物食恐竜の進化上の相互作用は時間と場所の不一致という観点から支持できないという結論が出されました(文献13、14)。ソテツ類の衰退は気候変動の中、被子植物との競争が招いたと考えられています(文献15))。ソテツ類という裸子植物の衰退も恐竜側の変化とは確かな関係はありそうにないのです。
実際に植物食恐竜が何を食べていたのかを知る手がかりとなるのが植物の名残りを含む排泄物(糞)の化石(文献16、17)ですが、その落とし主(ぬし)がわかりません。大変まれには恐竜の骨格化石中の消化器官があったと思われる部位からの痕跡の報告の例もあります(文献16、17)。これらの報告から植物食恐竜が裸子植物だけでなく、被子植物も食べていたらしいのですが、全般的なことを知るには無理があります。[なお、おもな裸子植物やシダ植物の代謝可能なエネルギーをヒツジの胃からの微生物を使って実験室での発酵から求めた結果によると、ジュラ紀の針葉樹の中には消化には時間がかかるものの、充分に巨大竜脚類のエネルギー源となりうるものがあったようです(文献18)。]
結局、恐竜の進化と被子植物の進化の間に深い関わり合いがあったという可能性を積極的に支持する証拠は得られず、むしろそれぞれの進化にかかわったより大きな要因は他に求められるということです。被子植物の繁栄に影響が大きかったと考えられ、古くから注目されてきた生物学的な要因は花粉を媒介する動物、なかでも昆虫です(文献19~25)。
昆虫は古生代中期のデボン紀に起源があるとされています(文献26)。被子植物登場以前の古い時代から、昆虫は裸子植物の花粉を媒介していたことを示すいくつもの証拠の報告が続いています(文献19、27、28)。化石標本(琥珀(こはく)の中にともに閉じ込められた昆虫と花粉や植物本体の一部なども)は、昆虫の口もと(吻(ふん))を含む頭部の形態と植物の花粉や胚珠とその周囲の構造をとおして、昆虫と植物の進化上の相互作用を強く示唆します。この古くからの関係の一部は裸子植物から被子植物へそのまま移行したこともあるものの、多くは被子植物の誕生後に新たに出現したようです。そもそも、被子植物の特徴である、胚珠が子房に包まれるようになったのも、昆虫に食われることへの対応の結果が大きかったのかもしれません(文献19)。
恐竜の食性の変化が被子植物の繁栄を招いた、そしてこれが被子植物と恐竜が相互に深く関連し合う進化へ進んだという考えは学説としては弱いものになってしまいました。本来、生物の分類グループ間の進化における相互作用は大変多くの要素がからむ問題で、厳密な考察は簡単ではありません。仮に対象となる異なる分類グループの進化の系統をさかのぼって、多様化にからむ出来事の時間と場所が一致したとしても、それだけでそのグループ間の直接相互作用の結果と結論づけることはできないからです。
共進化による生物多様化の考え
共進化(coevolution)は二つ、あるいはそれ以上の数の異なる生物種(あるいは種より上位または下位に属する分類グループ;相互作用しあうものどうしの直接の遺伝情報の交換はない関係)の間の相互作用を介した環境に適応する変化が積み重なった結果、生じる自然選択です(文献29~34)。対象はある特定の花とこれに集まる特定の昆虫のような種(しゅ)に限った関係から、もっと大きな分類グループ間にいたるまでのいろんなレベルで考察されます。植物と昆虫の全体がともに影響し合って進化してきたというようなおおくくりの表現、さらには生物と非生物との関係を記述する時にも登場することがあります。前項までに紹介した恐竜進化と被子植物の繁栄についての一連の研究も、共進化の観点から論じられています。
相互作用は競争的なもの、敵対的なもの、互いに利益を得る相利共生的なものがあり得ます。直接相互作用しているものどうしだけでなく、同じような役割をもつメンバーなど、環境内で共存する他の分類グループにも影響が及ぶことも考慮しなければなりません。したがって、共進化がより広い範囲にもたらす効果はコミュニティ(さまざまなメンバーが共存している社会全体)の進化(community evolution)につながることを、古くからこれら一連の研究は考察の対象にしてきました(文献29)。ネットワーク構造の概念を取り入れた最近の研究からも、相互関係が複数存在するシステムの場合に間接的な作用が加わり、より強い結果が生じることも示されています(文献34)。厳密な考察には多面的なデータが必要です。
被子植物の花とハチドリは共進化による結果の典型のひとつとされ、その中でも最も注目されてきたものはクチバシの長い特定のハチドリと、このクチバシの形状に合った構造をもつ特定の花との関係でしょう。しかし、こうした一見単純な関係にみえる場合ですら、同じような関係にある生物種への影響や未知の絶滅種の可能性などのいろんな要因があり、原因と経過についての厳密な考察をおこなうのはなかなかやっかいなようです(文献35)。
ともあれ、長い時間をかけた複雑な出来事の積み重ねの結果、今日みられるようなさまざまな動物-植物間の相互関係ができてきたことは確かです。たとえば、温室内の孤立した環境でアブラナ科の植物に対して、花粉を媒介するマルハナバチ、または植物体を食べるイモムシ、またはその両方を与え、これらの組み合わせによる影響の結果として現れる数世代後の植物側の性質(表現型)を調べた研究があります(文献36)。この実験結果は植物側のハチの花への誘導、イモムシに対する防御、そして交配に素早い変化が生じ、選択の圧力への的確な対応が発揮されることを示しました。植物がこれまでの進化の歴史の中で獲得し、蓄積してきた花粉媒介と被食をとおした生存にかかわる環境変化への適応のポテンシャルの高さを示すものです。
相互に影響する進化の複雑さを垣間見る別の例としてアリと植物の関係があります。昆虫の中でも最も種類も個体数も多いアリは中生代に出現しており、植物とは互いに影響しながら進化してきていることは確かです。しかし、その過程も複雑で、両者の多様性獲得の速度には違いがあります(文献37)。この場合は被子植物の進化がより進んだ状況になってから明確な相互作用が現れてきたのではとも考えられます。時間的ギャップも考慮しなければならない場合も確かにあるでしょう。
恐竜のように植物の種類にはそれほどかまわず(この点も、どの程度などか、はっきりしていないのですが)、とにかく大量に消費する大型動物よりは、小さな動物である昆虫や小型哺乳類のほうが被子植物との相互関係において種(しゅ)やその他の分類グループに特化した効果を与えるため、互いの進化に影響しやすいということがあるのでしょう。特に昆虫は世代サイクルも短く、遺伝的変化の獲得も容易です。さらに、その消化管の中で食べたものの消化などにかかわっている微生物はもっと素早い適応が可能です。微生物は宿主と一体とみなされることが普通ですが、実際に起こった出来事の中ではこんなところまでが含まれるはずであり、まさに単独相互作用を越えた複雑なネットワークが機能するのでしょう。
全般的には恐竜と植物との相互作用は進化に明らかな痕跡を残すことが少なく、こうした効果の違いの中に埋もれやすい運命にあったといってよいのではないでしょうか。
文献
1: Frohlich, M. W. and M. W. Chase (2007). Nature, Vol 450, 1184.
2: Doyle, J. A. (2012). Ann. Rev. Earth Planet. Science, Vol. 40, 301.
3: Sauquet, H. et al. (2017). Nature Commun., Vol. 8, 16047.
4: Benton, M. J. et al. (2022). New Phytol., Vol. 233, 2017.
5: Bakker, R.T. (1978). Nature, Vol. 274, 661.
6: Wing, S.L. & Tiffney, B.H. (1987). Rev. Palaeobot. Palynol. 50: 179–210.
7: Weishampel, D.B. & Norman, D.B. (1989). Spec. Pap. Geol. Soc. Am. 238: 87–100.
8: Coe, M.J., et al. (1987). In: The Origin of Angiosperms and their Biological Consequences (Friis, E. M. et al., ed), pp. 225–258. Cambridge, University Press, Cambridge.
9: Weishampel, D.B. and Jianu, C. M. (2000). In: Evolution of Herbivory in Terrestrial Vertebrates: Perspectives from the Fossil Record (Sues, H. D., ed.), pp. 123–143. Cambridge University Press, Cambridge.
10: Barrett, P. M. and K. J. Willis (2001). Biol. Rev., Vol. 76, 411.
11: Butler, R. J. et al., (2009). J. Evol. Biol., Vol. 22, 446.
12: Mustoe, G.E. (2007). Cycad Newsl. 30: 6–9.
13: Butler, R. J. et al. (2009). Biol. Rev. Camb. Philos. Soc., Vol. 84, 73.
14: Nagalingum, N.S. et al. (2011). Science, Vol. 334, 796.
15: Condamine, F. L. et al., (2020). Proc. Natl. Acad. Sci. U.S.A. ,Vol. 117, 28867.
16: Sander, P. M. et al. (2010). In Plants in Mesozoic Time: Morphological Innovations, Phylogeny, Ecosystems (Gee, C. T., ed.), pp. 331–360, Indiana University Press, Bloomington.
17: Brown, C. M. et al. (2020). R. Soc. Open Sci., Vol. 7, 200305.
18: Hummel, J. et al. (2008). Proc. Biol. Sci,, Vol. 7, 1015.
19: Grimaldi, D. (1999). Ann. Miss. Bot. Gard., Vol. 86, 373.
20: Hu, S. et al. (2008). Proc. Natl. Acad. Sci. U.S.A., Vol. 105, 240.
21: Labandeira, C.C. (2010). Ann. Mo. Bot. Gard., Vol. 97, 469.
22: Van der Niet, T. and S. D. Johnson (2012). Trends Ecol. Evol., Vol. 27, 353.
23: Van der Niet, T. et al. (2014). Ann. Botany, Vol. 113, 199.
24: Bao, T. et al. (2019). Proc. Natl. Acad. Sci. U.S.A., Vol. 116, 24707.
25: Peris, D. et al. (2020). iScience, doi: 10.1016/j.isci.2020.100913.
26: Misof, B. et al., (2014). Science, Vol. 346, 763.
27: Peñalver, E. et al. (2015). Curr. Biol., Vol. 25, 1917.
28: Peris, D. et al., (2017). Curr. Biol., Vol. 27, 1.
29: Ehrlich, P. R. and P. H. Raven (1964). Evolution, Vol.18, 586.
30: Janzen, D. H. (1980). Evolution, Vol. 34, 611.
31: Janz, N. (2011). Ann. Rev. Ecol. Evol. Syst., Vol. 42, 71.
32: Althoff, D. M. et al. (2014). Trends. Eco. Evol. Vol. 29, 82.
33: Hembry, D. H. et al. (2014). Am. Nat., Vol. 184, 425.
34: Guimarães, P. R. Jr. et al. (2017). Nature, Vol. 550, 511.
35: Leimberger, K. G. et al. (2022). Biol. Rev., doi: 10.1111/brv.12828.
36: Ramos, S. E. and F. P. Schiestl (2019). Science, Vol. 364, 193.
37: Nelsen, M. P. et al. (2018). Proc. Natl. Acad. Sci. U.S.A., Vol. 115 , 12253.
Copyright © Ittoriki __All rights reserved.